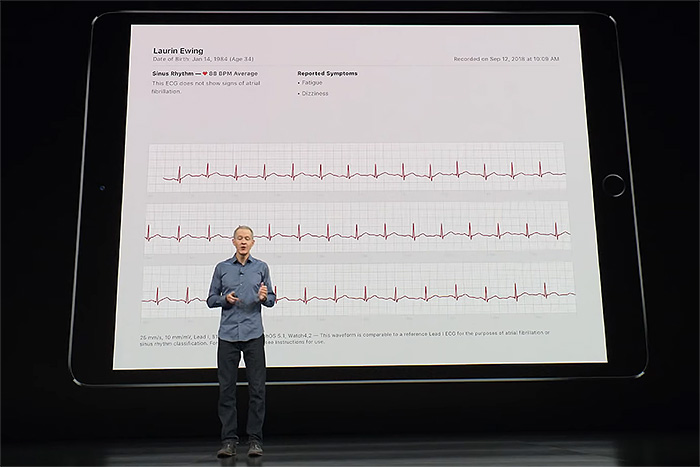
애플이 지난 9월 12일(미국 현지 시각)에 발표한 애플 워치 시리즈 4(이하 애플 워치 4)는 다른 스마트워치와 다른 기능이 하나 있다. 심장이 규칙적으로 뛰는지 확인할 수 있는 심전도(electrocardiogram, ECG)다. 심장동맥과 부정맥 질환을 진단할 때 가장 많이 쓰는 심전도 검사를 손목에 찬 애플 워치로 할 수 있게 된 것이다.
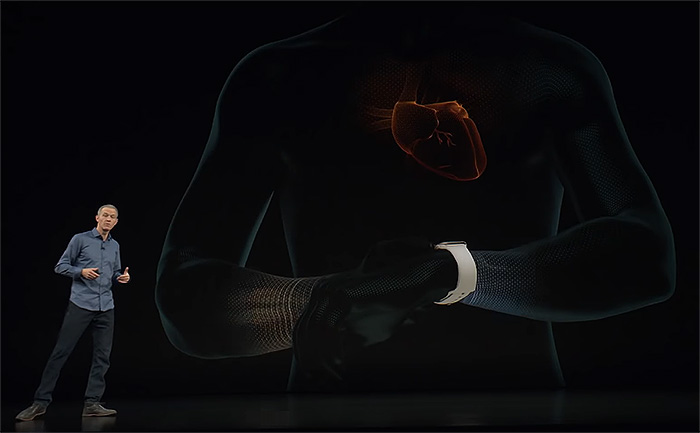
이미 이전 세대의 애플 워치를 비롯한 많은 스마트워치에 심박수 측정 기능을 싣고 있지만, 심전도 측정은 다르다. 손목의 혈류를 감시하는 광학 센서(photoplethysogram)로 분당 심장이 몇 번 뛰는지 셀 수는 있지만, 그것이 얼마나 정기적으로 뛰는지는 알려주지 않는다. 반면 심전도는 혈액을 순환시키는 조심스럽게 조율된 순서로 수축을 일으키는 전기 신호를 측정하는 것으로 애플 워치 4는 왼팔과 오른판의 전위차를 기록하는 유도 I(Lead I) 방식을 쓴다. 탈분극으로 심근이 수축과 이완을 반복할 때 왼팔과 오른팔로 전달되는 미세한 전기 신호를 애플 워치 4의 바닥 면과 용두에 있는 ECG 센서로 측정하고 이를 증폭해 기록하도록 설계했다.
하지만 심전도 기능을 가진 애플 워치 4에 대한 오해도 적지 않은 듯하다. 이 기능을 쓸 수 있도록 FDA 승인을 받은 과정은 대부분 베일에 가려진 상태였고, 정확하게 무엇을 승인 받았는지 혼선이 있었으며, 이용 조건에 대한 불분명한 요소도 남아 있었다. 처방전을 받지 않고 심전도를 측정할 수 있는 장치라는 점은 사실이지만, 모든 이용자에게 해당하는 것은 아닌 점도 잘 전달되지 않았다. 여러 오해가 쌓이다 보니 우리나라에서는 “원격 진료를 금지한 상태여서 애플 워치 4의 심전도를 쓰지 못한다”는 조금 황당한 의견도 나오는 상황이다. 이러한 오해가 나온 배경이 어디에 있는지 모르지만, 애플 워치 4의 심전도 승인과 관련된 몇 가지 이야기의 정리가 필요해 보이긴 한다.
그런데 미국 FDA가 애플에 보낸 서한을 꼼꼼히 읽어봐도 애플 워치 4라는 하드웨어를 ECG 장치로 승인한 부분을 발견할 수 없다. 애플은 미국 FDA에서 정해 놓은 항목이 없을 때 신청하는 디 노보(De Novo) 분류로 ECG 앱과 불규칙 리듬 알림 기능(Irregular Rhythm Notification Feature) 등 두 가지에 대한 기능성을 검토해 달라고 요청했는데, FDA는 각각 기능에 대해 검토하고 몇 가지 단서를 달아 클래스 2의 안전성 등급으로 승인했을 뿐 애플 워치 4를 명시하지는 않았던 것이다.
이처럼 애플은 FDA로부터 승인받은 두 가지 소프트웨어를 탑재하고 애플 워치 4를 발표하면서 심전도 기능을 발표한 것이다. 그러니까 애플 워치 4 자체는 처음부터 의료 기기는 아니지만, 애플 워치 4에 실린 소프트웨어가 의료 기기로 분류되어 있으므로 이를 실행하는 애플 워치 4도 문제 없이 출시할 수 있게 된 것이다.
이쯤되니 이상한 생각이 들 것이다. 의료 기기인데 하드웨어가 아니라 소프트웨어를 승인 받아 애플 워치를 의료 기기로 바꿔놨으니 말이다. 바로 이 부분이 중요하다. 물리적인 하드웨어를 의료 기기로 승인 받은 게 아니라 소프트웨어를 통해 하드웨어를 의료 기기로 바꾼 것인데, 매우 영리한 전략을 선택한 애플과 미국 FDA의 합작한 결과다. 실제로 전통적인 방법으로 물리적인 의료 기기를 승인 받는 일은 미국을 비롯해 세계 어디에서나 매우 어려운 일이다. 작은 진단 장치 조차 수년 동안 임상 시험을 거쳐 FDA의 까다로운 조건을 충족해야만 하고 이는 천하의 애플이라도 특혜를 받지 않고는 해결하기 힘든 일이다.
결과적으로 미국에서 애플 워치 4에 넣은 불규칙 리듬 알림 기능과 ECG 앱이 검토를 무사히 마친 것은 의료 기기로서 소프트웨어에 대해 FDA에서 새로운 인증 프레임워크를 준비해 온 영향도 적지 않아 보인다. FDA는 지난 해 의료 기기로서 소프트웨어를 대상으로 하는 소프트웨어 사전 인증(Pre-Cert) 파일럿 프로그램을 시작했고, 여기에 애플과 구글, 삼성 등 9개 기업이 참여했다. 당시 FDA는 ‘이러한 기술에 대한 환자의 접근을 방해하지 않으면서 소프트웨어 기술의 안전성과 효율성을 평가하는 새로운 규제 모델의 개발을 알리기 위한 것’이라며 파일럿 프로그램을 소개했다. 의료 기기로서 소프트웨어를 인증하기 위한 검증 방법을 찾으려는 FDA가 환자 안전, 제품 품질, 임상적 책임, 사이버 보안 책임 및 적극적인 문화 등 다섯 가지 원칙을 마련하고 이를 기업들에게 실험하고 있는 상황이었던 것이다.
중요한 점은 파일럿 프로그램에 참여한 애플의 요청에 대해 FDA가 검토하고 승인하는 데 불과 1개월 정도 밖에 걸리지 않았다는 점이다. 고품질의 SaMD 제품을 개발할 수 있는 투명성과 우수한 문화, 그리고 신뢰를 줄 수 있는 조직인지 확인하는 소프트웨어 사전 인증 프로그램의 절차를 애플이 준수했고, 이에 맞춰 FDA는 간소한 검토를 통해 적극적으로 신기술을 구현한 소프트웨어 의료기기를 승인한 것으로 짐작할수 있는 부분이다.(다만 애플 워치 4보다 앞서 심전도 소프트웨어와 밴드형 ECG를 내놓았던 AliveCor는 이 같은 FDA의 사전 인증 프로그램 이전에 시행된 것이어서 방향성과 과정은 달랐을 것으로 보인다.)
이처럼 미국 FDA가 의료 기기로서 소프트웨어에 대한 인증 프로그램을 차근차근 준비해온 덕분에 애플에서 요청한 ECG 앱과 불규칙한 리듬 알림 앱을 승인하는 데 훨씬 용이한 환경을 갖췄고 결국 애플 워치 4에서 관련 기능을 쓸 수 있게 됐다. 하지만 이는 의료 기기로서 소프트웨어에 대한 환경을 준비한 미국에서 해당하는 이야기일 뿐, 우리나라는 해당 사항이 없다. 미국 FDA가 두 개의 소프트웨어를 의료 기기로 승인함으로써 애플 워치 4의 심전도를 쓸 수 있는 것과 달리 우리나라는 애플 워치의 심전도 기능을 어느 기관에서 어떻게 평가할 지 확정된 것도 없고 애플 코리아도 어떻게 접근할 지 입장을 정한 게 없기 때문이다.
심전도를 측정하는 의료 기기에 대해 우리나라에서 판정을 내리는 곳은 식품의약품안전처다. 하지만 의료 기기 내의 소프트웨어를 심의할 근거는 있지만, 미국처럼 소프트웨어를 의료기기로 심의하는 절차는 아직 없다. 당장 미국 FDA와 동일한 프로그램을 만들 수 없기 때문에 국내에서 애플 워치 4의 심전도를 쓸 가능성은 현저히 낮은 것이다. 안타까운 일이지만, 이것이 어쩔 수 없는 현실이다. 또한 그 쓸 수 없는 기능을 담은 애플 워치 4를 미국과 같은 값에 사야만 하는 것도 어쩔 수 없는 현실이다.